Eggstokkreft
Kreft i eggstokkene er ofte en diagnose som stilles sent, fordi sykdommen gir få og vage symptomer tidlig i forløpet. I mange tilfeller har sykdommen spredt seg når diagnosen stilles.

Sist oppdatert:
6. des. 2021
Kreft i eggstokkene
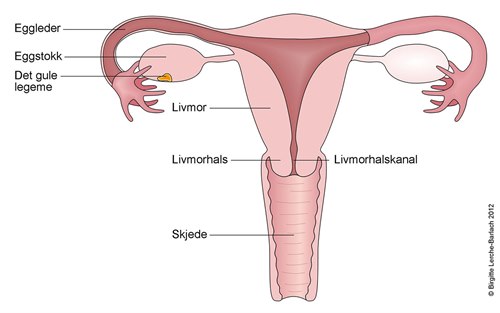 Kvinnens indre kjønnsorganer
Kvinnens indre kjønnsorganerKreft i eggstokkene er den tredje hyppigste form av gynekologisk kreft i Norge (brystkreft og livmorkreft er på henholdsvis første- og andreplass). Omtrent seks ganger flere får brystkreft.
Eggstokkreft kan stamme fra ulike vevstyper i eggstokken, og det betyr at det finnes flere forskjellige former av eggstokkreft. Omtrent 90 prosent av all kreft i eggstokkene dannes i overflaten av eggstokkene (såkalte epiteliale svulster), mens cirka ti prosent stammer fra det hormonproduserende kjertellaget inne i eggstokkene.
Både dødelighet og antall nye tilfeller har gått noe ned det siste tiårene. Sykdommen rammer hyppigst kvinner mellom 50 til 70 år, men kvinner i alle aldre kan få eggstokkreft. Årlig får vel 500 norske kvinner denne diagnosen. Dersom søster eller mor har hatt kreft i eggstokkene, går risikoen for å utvikle eggstokkreft i løpet av et helt liv opp fra cirka to prosent til cirka fem prosent. I gruppen hvor arv spiller en rolle, dukker sykdommen ofte opp i yngre alder enn hos de som utvikler kreft uten at nær familie er rammet.
Årsaker til kreft i eggstokkene
Kreft er karakterisert ved ukontrollert cellevekst. Det er ikke kjent hva som er årsaken til kreft i eggstokkene hos 85 prosent. Eggstokkreft forekommer noe hyppigere hos kvinner som ikke har fått barn, sammenlignet med dem som har født flere barn. Det synes også som om p-pillebruk beskytter noe mot utvikling av kreft i eggstokkene. Dette kan tyde på at hormoner eller forhold omkring eggløsninger kan ha noe med denne kreftformen å gjøre.
10 til 15 prosent av de som utvikler kreft i eggstokkene, har en arvelig faktor (hyppigst er mutasjon i BRCA1 eller BRCA2 genet). Alle som får eggstokkreft tilbys test for den arvelige varianten av sykdommen. Dersom man finner en arvelig komponent, kan både informasjon og håndtering av sykdommen tilrettelegges mer presist.
Symptomer
Eggstokkreft er vanskelig å påvise i tidlige stadier, og rutineundersøkelser eller "screening" for å avdekke denne kreftformen fører ikke til at flere blir oppdaget tidlig. Ofte oppdages eggstokkreft tilfeldig. I den første fasen av sykdommen foreligger ingen karakteristiske symptomer. Svulsten vokser i den tidlige fasen fritt uten å trykke på andre organer. Men etter som svulsten vokser, kan man oppleve smerter eller ubehag, endrede avføringsvaner eller endret vannlatingsmønster, blødningsforstyrrelse, følelse av oppfylthet, eventuelt slapphet og tretthet, dårlig appetitt og vekttap.
Diagnostikk
Noen tilfeller oppdages på grunn av underlivsplager som fører til legeundersøkelse. Men i mange tilfeller oppdages denne sykdommen tilfeldig i forbindelse med rutineundersøkelser. Ved vanlig gynekologisk undersøkelse kan det være mulig å kjenne en kul i eller rundt eggstokkene. Men 75 prosent av alle slike kuler er godarta.
Hvis fastlegen din mistenker at du kan ha kreft i eggstokkene, vil du bli henvist til en gynekolog. Ved hjelp av en ultralydundersøkelse utført via skjeden eller utenpå magen kan en komme nærmere å stille diagnosen. Sikker diagnose får man i mange tilfeller først ved operasjon og analyse av vevsprøve fra svulsten.
Det finnes ingen blodprøver som hjelper til å oppdage tilstanden i et tidlig stadium. En blodprøve, CA 125, kan være nyttig for å følge utviklingen av eggstokkreft, men prøven er ikke egnet for å stille diagnosen. I tidlig stadium er denne prøven ofte normal samtidig som en rekke andre ufarlige tilstander også kan gi økte verdier av CA 125.
Det er avgjørende for valg av behandling og for fremtidsutsiktene ved eggstokkreft å gjøre en vurdering av stadiet sykdommen er i. Det er vanlig å dele eggstokkreft inn i fire stadier basert på om og eventuelt hvor langt kreftcellene har spredt seg fra eggstokkene.
Ved stadium I er sykdommen begrenset til eggstokkene. Ved stadium IV har den spredt seg utenfor bukhulen. Mellom disse to finner vi stadiene II og III. Kreft i eggstokkene sprer seg som oftest ved at cellene vokser inne i bukhulen, hvor svulsten brer seg rundt organene. Kreftcellene kan også føres ut i kroppen via lymfeårene til lymfeknutene. I noen tilfeller sprer sykdommen seg til lever eller lunger via blodet.
Behandling
Behandlingen er avhengig av sykdommens utbredelse. Dersom sykdommen er i tidlig stadium, og den ikke er spredd til andre organer, vil man ha helbredelse som siktemål for behandlingen. Om sykdommen er langtkommet, vil lindring av plager og bremsing av veksten være det viktigste formålet med behandlingen.
Kirurgisk behandling
Hovedbehandlingen er kirurgisk fjerning av svulstvevet. I svært tidlig fase, og når man bedømmer risikoen for spredning av svulsten som liten, kan kirurgi alene være tilstrekkelig. I alle de øvrige tilfellene etterfølges den kirugiske behandling med en serie med medikamentell kreftbehandling. Operasjonen består vanligvis av at eggstokker, eggledere, livmor og lymfeknuter i området fjernes.
Medikamentell kreftbehandling
De fleste vil få medikamentell kreftbehandling i form av kjemoterapi ("cellegift") i tillegg til operasjon. Det gis for å fjerne mulige gjenværende kreftceller etter operasjon usynlige for det blotte øyet. For noen kan det være aktuelt å gi kjemoterapi før operasjonen dersom det er behov for å redusere mengden kreftvev for best mulig resultat av en operasjon.
Der det mistenkes at risikoen for tilbakefall er høy og der kreften skyldes arvelige endringer i BRCA1 eller 2 genet, suppleres behandlingen i tillegg med nyere kreftmedisin, såkalte monoklonale antistoffer og signalhemmere.
Strålebehandling
Strålebehandling er først og fremst brukt ved uhelbredelig eggstokkreft for å dempe og lindre plager.
Prognose
Eggstokkreft er ikke lett å påvise tidlig, og mange har derfor langtkommet sykdom når tilstanden påvises. Som ved all annen kreft er prognosen dårligere jo mer langtkommen sykdommen er. Det at den oppdages sent, bidrar derfor til at prognosen for denne krefttypen samlet sett er forholdsvis dårlig. For hele gruppen samlet per 2020 levde 50 prosent i fem år eller mer etter sykdommen. For gruppen som ble oppdaget i tidlig fase, var nær 100 prosent fortsatt i live etter fem år.
Dette dokumentet er basert på det profesjonelle dokumentet Ovarialkreft . Referanselisten for dette dokumentet vises nedenfor
- Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for gynekologisk kreft. Eggstokkreft, tubekreft og bukhinnekreft. 28.06.2021. Siden besøkt 11.11.2021 helsedirektoratet.no
- Doubeni CA, Doubeni ARB, Myers AE. Diagnosis and management of ovarian cancer. Am Fam Physician. 2016 Jun 1;93(11):937-944.
- Kreftregisteret. Cancer in Norway 2020. Oslo: Kreftregisteret, 2021. www.kreftregisteret.no. www.kreftregisteret.no
- Jelovac D, Armstrong DK. Recent progress in the diagnosis and treatment of ovarian cancer. CA Cancer J Clin. 2011;61(3):183–203.
- Pruthi S, Gostout BS, Lindor NM. Identification and management of women with BRCA mutations or hereditary predisposition for breast and ovarian cancer. Mayo Clin Proc. 2010;85(12):1111–1120.
- Hunn J, Rodriguez GC. Ovarian cancer: etiology, risk factors, and epidemiology. Clin Obstet Gynecol. 2012;55(1):3–23.
- Chen S, Parmigiani G. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol. 2007;25(11):1329–1333.
- Jordan SJ1, Whiteman DC, Purdie DM, Green AC, Webb PM. Does smoking increase risk of ovarian cancer? A systematic review. Gynecol Oncol 2006; 103: 1122-9. pmid:17005245 PubMed
- Mørch LS, Løkkegaard E, Andreasen AH, Krüger-Kjær S, Lidegaard Ø. Hormon therapy and ovarian cancer. JAMA 2009; 302: 298-305. Journal of the American Medical Association
- Collaborative Group on Epidemiological Studies of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet 2015. doi:10.1016/S0140-6736(14)62458-2 DOI
- Rizzuto I, Behrens RF, Smith LA. Risk of ovarian cancer in women treated with ovarian stimulating drugs for infertility. Cochrane Database of Systematic Reviews 2019, Issue 6. Art. No.: CD008215. DOI: 10.1002/14651858.CD008215.pub3. Accessed 03 December 2021. The Cochrane Library
- Michels KA, Pfeiffer RM, Brinton LA, et al. Modification of the Associations Between Duration of Oral Contraceptive Use and Ovarian, Endometrial, Breast, and Colorectal Cancers. JAMA Oncol 2018. doi:10.1001/jamaoncol.2017.4942 DOI
- Moorman PG, Havrilesky LJ, Gierisch JM, et al. Oral contraceptives and risk of ovarian cancer and breast cancer among high-risk women: a systematic review and meta-analysis. J Clin Oncol. 2013;31(33):4188–4198.
- Iversen L, Fielding S, Lidegaard Ø, et al. Association between contemporary hormonal contraception and ovarian cancer in women of reproductive age in Denmark: prospective, nationwide cohort study BMJ 2018; 362 :k3609. DOI: 10.1136/bmj.k3609. DOI
- Kjaer SK, Mellemkjaer L, Brinton LA, Johansen C, Gridley G, Olsen JH. Tubal sterilization and risk of ovarian, endometrial and cervical cancer: a Danish population-based follow-up study of more than 65 000 sterilized women. Int J Epidemiol 2004; 33: 596-602. PubMed
- Menon U, Gentry-Maharaj A, Burnell M et al. Ovarian cancer population screening and mortality after long-term follow-up in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet. 2021 Jun 5;397(10290):2182-2193. Epub 2021 May 12. PMID: 33991479 PubMed
- Buys SS, Partridge E, Black A, et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. JAMA. 2011;305(22):2295–2303.
- Henderson JT., Webber EM., Sawaya GF.. Screening for Ovarian Cancer Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA 2017; 319: 595-606. doi:10.1001/jama.2017.21421 DOI
- Paulsen T, Kærn J, Kjærheim K, Tropé C, Tretli S. Symptoms and referral of women with epithelial ovarian tumors. Int J Gynaecol Obstet 2005;88(1):31–7. PMID: 15617702. PubMed
- Baun ML, Jensen H, Falborg AZ et al. Ovarian cancer suspicion, urgent referral and time to diagnosis in Danish general practice: a population-based study. Fam Pract. 2019 Nov 18;36(6):751-757. PMID:31046091. PubMed
- Liu JH, Zanotti KM. Management of the adnexal mass. Obstet Gynecol. 2011;117(6):1413–1428.
- Barney SP, Muller CY, Bradshaw KD. Pelvic masses. Med Clin North Am 2008; 92: 1143-61. PubMed
- Sevinc A, Adli M, Kalender ME, Camci C. Benign causes of increased serum CA-125 concentration. Lancet Oncol 2007; 8: 1054-5. PubMed
- Cannistra SA. Cancer of the ovary. N Engl J Med. 2004;351(24):2519–2529.
- Ameye L, et al. Clinically oriented three-step strategy for assessment of adnexal pathology. Ultrasound Obstet Gynecol. 2012;40(5):582–591.
- Timmerman D, Ameye L, Fischerova D, et al. Simple ultrasound rules to distinguish between benign and malignant adnexal masses before surgery: prospective validation by IOTA group. BMJ. 2010;341:c6839.
- Zhang S, Yu S, Hou W, et al. Diagnostic extended usefulness of RMI: comparison of four risk of malignancy index in preoperative differentiation of borderline ovarian tumors and benign ovarian tumors. J Ovarian Res. 2019;12(1):87. Published 2019 Sep 16. PMID: 31526390. PubMed
- Lawrie TA, Winter-Roach BA, Heus P, Kitchener HC. Adjuvant (post-surgery) chemotherapy for early stage epithelial ovarian cancer. Cochrane Database of Systematic Reviews 2015, Issue 12. Art. No.: CD004706. DOI: 10.1002/14651858.CD004706.pub5 DOI
- Stockler MR, Hilpert F, Friedlander M etal. Patient-reported outcome results from the open-label phase III AURELIA trial evaluating bevacizumab-containing therapy for platinum-resistant ovarian cancer. J Clin Oncol. 2014 May 1;32(13):1309-16. Epub 2014 Mar 31. PMID: 24687829 PubMed
- Morrison J, Haldar K, Kehoe S, Lawrie TA. Chemotherapy versus surgery for initial treatment in advanced ovarian epithelial cancer. Cochrane Database of Systematic Reviews 2012; 8: CD005343. DOI: 10.1002/14651858.CD005343.pub3. DOI
- Rauh-Hain JA, Melamed A, Wright A. Overall Survival Following Neoadjuvant Chemotherapy vs Primary Cytoreductive Surgery in Women With Epithelial Ovarian Cancer. JAMA Oncol 2017; 3(1): 76-82. pmid:27892998 PubMed
- Melamed A, Fink G, Wright AA, et al. Effect of adoption of neoadjuvant chemotherapy for advanced ovarian cancer on all cause mortality: quasi-experimental study. BMJ 2018; 360: j5463. doi:10.1136/bmj.j5463 DOI
- Fung-Kee-Fung M1, Oliver T, Elit L. Optimal chemotherapy treatment for women with recurrent ovarian cancer. Curr Oncol 2007; 14: 195-208. pmid:17938703 PubMed
- Mansoor R. Mirza, M.D., Bradley J et al.. Niraparib Maintenance Therapy in Platinum-Sensitive, Recurrent Ovarian Cancer. N Engl J Med 2016. pmid:27717299 PubMed
- Moore KN, Secord AA, Geller MA, et al. Niraparib monotherapy for late-line treatment of ovarian cancer (QUADRA): a multicentre, open-label, single-arm, phase 2 trial published correction appears in Lancet Oncol. 2019 May;20(5):e242. Lancet Oncol. 2019;20(5):636-648. PMID: 30948273. PubMed
- Mirza MR, Coleman RL, González-Martín A et al. The forefront of ovarian cancer therapy: update on PARP inhibitors. Ann Oncol. 2020 Jun 19:S0923-7534(20)39891-4. Epub ahead of print. PMID: 32569725. PubMed
- Wiggans AJ, Cass GKS, Bryant A, Lawrie TA, Morrison J. Poly(ADP‐ribose) polymerase (PARP) inhibitors for the treatment of ovarian cancer. Cochrane Database of Systematic Reviews 2015, Issue 5. Art. No.: CD007929. DOI: 10.1002/14651858.CD007929.pub3. Accessed 06 December 2021. The Cochrane Library