Clostridioides difficile tarminfeksjon
Tarminfeksjon forårsaket av bakterietypen Clostridioides difficile er en diarésykdom som kan oppstå etter bruk av antibiotika. Infeksjonen rammer hyppigst eldre og personer med svekket immunitet.

Sist oppdatert:
18. nov. 2024
Hva er Clostridioides difficile?
Tarminfeksjon forårsaket av bakterietypen Clostridioides difficile er en diarésykdom som kan oppstå etter bruk av antibiotika. Infeksjonen rammer hyppigst eldre eller voksne med generelt svekket helse. Spedbarn utvikler svært sjelden C. difficile-infeksjoner.
Sykdommens alvorlighetsgrad kan variere mye. Noen kan slippe unna med noen få episoder med løs avføring. Andre kan få kraftig diaré som kan være blodtilblandet - tilstanden kalles da for pseudomembranøs kolitt. I de alvorligere tilfellene får man ofte også feber, magesmerter og sykdomsfølelse.
Forekomsten er økende rundt i verden, på grunn av økende bruk av bredspektrede antibiotika. I Norge er forekomsten ganske stabil med ca. 3000 meldte tilfeller årlig.
Infeksjon med C. difficile er en av de hyppigste årsakene til diarésykdom som oppstår hos pasienter i sykehus. C. difficile-infeksjon utgjør ca. 20-30 prosent av antibiotika-utløste tilfeller av diaré, og nær alle tilfeller av pseudomembranøs kolitt. Kolitt betyr betennelse i tykktarmen.
Tilstanden er en stor belastning for pasienter som på forhånd er svekket, og kan føre til langvarige sykehusopphold.
Årsaker
Antibiotika endrer den normale bakteriefloraen i tarmen, og legger til rette for oppvekst av clostridier. Ca 20 prosent av dem som bruker antibiotika, får diaré. 20-30 prosent av disse igjen skyldes C. difficile. Bakterien danner toksiner (giftstoffer) som kan skade tarmslimhinnen, og som kan gi alt fra en lett irritasjon til en kraftig betennelse i tykktarmslimhinnen med blodig diaré.
2-3 prosent av friske voksne er bærere av Clostridiumbakterien, og bakterien er funnet i tarmen hos opptil 35 prosent av pasienter som er inneliggende i sykehus. Bakterien kan overleve lenge på gjenstander i sykehusmiljø, og den kan overføres via helsearbeideres hender eller instrumenter. C. difficile sporer kan overleve i omgivelser i mange måneder. Bakterien kan også overføres ved kontaktsmitte mellom pasienter.
Sykdommen er en forbundet med bruk av såkalt bredspektrede antibiotika. Det er økt risiko med økende antibiotikadose, med økt varighet av behandling, og med antall antibiotika som er brukt. Blant annet er det funnet 8 ganger økt risiko hos pasienter som antibiotikabehandles i mer enn 18 dager sammenlignet med pasienter som behandles mindre enn 4 dager. Risiko for C. difficile er betydelig økt under antibiotikabehandling og den første måneden deretter. Risiko avtar gradvis, men er fortsatt økt 2-3 måneder etter antibiotikabehandling.
Symptomer
Symptomene melder seg oftest 4-8 dager etter påbegynt antibiotikabehandling, men den kan opptre fra første dag etter oppstart, og opptil 2-3 måneder etter avsluttet antibiotikabehandling. Symptomene er hyppig og løs avføring, av og til med blod eller slim. Diaréen varierer fra noen få episoder med løs avføring til betydelige, blodige tømninger ledsaget av feber, magesmerter og svekket allmenntilstand. Den alvorligste varianten kalles pseudomembranøs kolitt.
Eldre får oftere alvorlig forløp og tilbakefall enn yngre, og immunsvekkede pasienter er spesielt utsatt. Enkelte kan gjennom flere år ha kronisk tilbakevendende diaré.
Diagnostikk
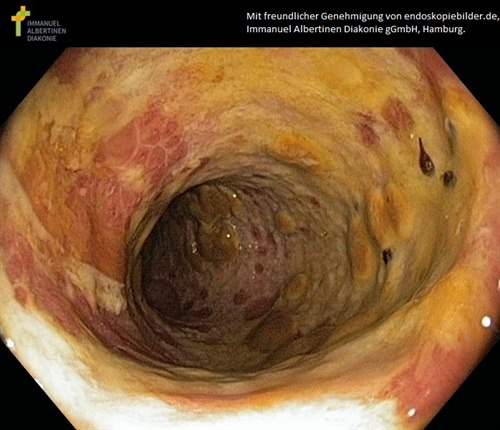 Slimhinneforandringer ved clostridioides tarminfeksjon
Slimhinneforandringer ved clostridioides tarminfeksjonDiagnosen stilles ved påvisning av toksin eller clostride-bakterien i avføringsprøve.
De fleste som får alvorlig diaré som følge av antibiotikabruk, er inneliggende pasienter på sykehus. Men noen ganger starter sykdommen hos hjemmeværende pasienter, og ved alvorlig diaré kan det være nødvendig med innleggelse på sykehus.
Behandling
Mange pasienter har milde symptomer og behøver ikke behandling. Dersom det er mulig å avslutte kuren med antibiotika, er dette ofte tilstrekkelig behandling.
Hos de som har mer uttalte symptomer, er det nødvendig med mer intensiv behandling i form av væskebehandling intravenøst, og man vil slutte med eller skifte til andre typer antibiotika enn de som utløste infeksjonen. Dette er behandling som krever innleggelse i sykehus for de som ikke allerede er innlagt. I de aller alvorligste tilfellene kan det til og med bli aktuelt med operasjon.
Prognose
I de letteste tilfellene går sykdommen over av seg selv når man slutter med det utløsende antibiotikumet. I mer alvorlige tilfeller må det gis antibiotika mot clostridium-infeksjonen, og det kan bli nødvendig med intensiv-behandling i sykehus.
Trusselen fra denne bakterien er en av flere grunner til at man generelt, både i og utenfor sykehus, forsøker å begrense bruken av antibiotika så mye som mulig. Antibiotika er livreddende og helt nødvendig ved mange alvorlige infeksjoner, men behandlingen kan også føre til alvorlige bivirkninger.
Dette dokumentet er basert på det profesjonelle dokumentet Clostridioides difficile tarminfeksjon . Referanselisten for dette dokumentet vises nedenfor
- Helsedirektoratet. Nasjonal faglig retningslinje. Antibiotikabruk i primærhelsetjenesten (HDIR). Antibiotikaassosiert diaré. Sist oppdatert 12.09.2023. Lest 14.11.2024
- Johnson S, Lavergne V, Skinner AM et al. Clinical Practice Guideline by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. Clin Infect Dis. 2021 Sep 7;73(5):755-757. PMID: 34492699 PubMed
- Folkehelseinstituttet. Smittevernhånboka. Clostridioides difficile (Clostridium difficile)-infeksjon - håndbok for helsepersonell. Folkehelseinstituttet, sist oppdatert 06.06.2023.
- Folkehelseinstituttet. Forekomst av antibiotikaresistente bakterier og sopp. Clostridioides difficile-infeksjoner (CDI). Oppdatert 11.11.2024. Siden lest 18.11.2024 cms.legehandboka.no
- Best EL, Fawley WN, Parnell P, Wilcox MH. The potential for airborne dispersal of Clostridium difficile from symptomatic patients. Clin Infect Dis 2010; 50: 1450-7. PubMed
- Loo VG, Brassard P, Miller MA. Household transmission of Clostridium difficile to family members and domestic pets. Infect Control Hosp Epidemiol 2016 Nov; 37:1342. PMID: 27767004 PubMed
- Miller AC, Segre AM, Pemmeraju SV, et al. Association of Household Exposure to Primary Clostridioides difficile Infection With Secondary Infection in Family Members. JAMA Netw Open 2020; 3: e208925. doi:10.1001/jamanetworkopen.2020.8925 DOI
- Petrella LA, Sambol SP, Cheknis A, et al. Decreased cure and increased recurrence rates for Clostridium difficile infection caused by the epidemic c. difficile BI strain. Clin Infect Dis 2012; 55: 351-7. PubMed
- Deshpande A, Pasupuleti V, Thota P, et al. Community-associated Clostridium difficile infection and antibiotics: a meta-analysis. J Antimicrob Chemother 2013. pmid: 23620467 PubMed
- Brown KA, Khanafer N, Daneman N, Fisman DN. Antibiotics and the risk of community-associated Clostridium difficile infection (CDI): a meta-analysis. Antimicrob Agents Chemother 2013. doi:10.1128/AAC.02176-12 DOI
- Stevens V, Dumyati G, Fine LS, et al. Cumulative antibiotic exposures over time and the risk of clostridium difficile infection. Clin Infect Dis 2011; 53: 42-8. PubMed
- Hensgens MP, Goorhuis A, Dekkers OM, Kuijper EJ. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67: 742-8. PubMed
- Winslow BT, Onysko M, Thaompson KA, et al. Common questions about Clostridium difficile infection. Am Fam Physician. 2014 Mar 15;89(6):437-442. PubMed
- Kwok CS, Arthur AK, Anibueze CI, et al. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: Meta-analysis. Am J Gastroenterol 2012; doi: 10.1038/ajg.2012.108. DOI
- Zacharioudakis IM, Zervou FN, Pliakos EE, et al. Colonization with toxinogenic C. difficile upon hospital admission, and risk of infection: A systematic review and meta-analysis. Am J Gastroenterol 2015 Mar; 110:381. PMID: 25732416 PubMed
- Chia J-H, Wu T-S, Wu T-S, et al. Clostridium innocuum is a vancomycin-resistant pathogen that may cause antibiotic-associated diarrhea. Clin Microbiol Infect. 2018. pmid:29458157 PubMed
- Nelson RL, Suda KJ, Evans CT. Antibiotic treatment for Clostridium difficile‐associated diarrhoea in adults. Cochrane Database of Systematic Reviews 2017, Issue 3. Art. No.: CD004610. DOI: 10.1002/14651858.CD004610.pub5. Accessed 23 June 2022. The Cochrane Library
- Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol. 2014 ;48:693-702. doi: 10.1097/MCG.0000000000000046 DOI
- Pillai A, Nelson RL. Probiotics for treatment of Clostridium difficile-associated colitis in adults. Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD004611. DOI: 10.1002/14651858.CD004611.pub2 DOI
- Hogan CA, Hotchcock MM, Frost S, et al. Clinical Outcomes of Treated and Untreated C. difficile PCR-Positive/Toxin-Negative Adult Hospitalized Patients: a Quasi-Experimental Noninferiority Study. J Clin Microbiol 2022; 60: e0218721. pmid:35611653 PubMed
- Helsedirektoratet. Antibiotika i sykehus. Nasjonal faglig retningslinje for bruk av antibiotika i sykehus. Sist oppdatert 01.03.2022. Siden besøkt 01.03.2023
- Baunwall SMD, Andreasen SE, Hansen MM, et al. Faecal microbiota transplantation for first or second Clostridioides difficile infection (EarlyFMT): a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol 2022. pmid:36152636 PubMed
- Linsky A, Gupta K, Lawler EV, Fonda JR, Hermos JA. Proton pump inhibitors and risk for recurrent Clostridium difficile infection. Arch Intern Med 2010; 170: 772-8. PubMed
- Oughton MT, Loo VG, Dendukuri N, et al. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol 2009; 30: 939-44. PubMed
- Stone SP, Fuller C, Savage J, et al. Evaluation of the national Cleanyourhands campaign to reduce Staphylococcus aureus bacteraemia and Clostridium difficile infection in hospitals in England and Wales by improved hand hygiene: four year, prospective, ecological, interrupted time series study. BMJ 2012; 344: e3005. BMJ (DOI)
- Goldenberg JZ, Mertz D, Johnston BC, et al. Probiotics to Prevent Clostridium difficile Infection in Patients Receiving Antibiotics. JAMA 2018. doi:10.1001/jama.2018.9064 DOI
- Goldenberg JZ, Yap C, Lytvyn L, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database Syst Rev. 2017; 12: CD006095. PMID: 29257353 PubMed
- Guo Q, Goldenberg JZ, Humphrey C, El Dib R, Johnston BC. Probiotics for the prevention of pediatric antibiotic‐associated diarrhea. Cochrane Database of Systematic Reviews 2019, Issue 4. Art. No.: CD004827. Cochrane (DOI)
- Tariq R, Syed T, Yadav D, et al. Outcomes of Fecal Microbiota Transplantation for C. difficile Infection in Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. J Clin Gastroenterol. 2021. PMID: 34864789 PubMed
- Feuerstadt P, Louie TJ, Lashner B, et al. SER-109, an Oral Microbiome Therapy for Recurrent Clostridioides difficile Infection. N Engl J Med 2022; 386: 220-229. pmid:35045228 PubMed
- Cohen SH, Louie TJ, Sims M, et al. Extended Follow-up of Microbiome Therapeutic SER-109 Through 24 Weeks for Recurrent Clostridioides difficile Infection in a Randomized Clinical Trial. JAMA 2022. pmid:36260754 PubMed
- Wilcox MH, Gerding DN, Poxton IR, et al. Bezlotoxumab for Prevention of Recurrent Clostridium difficile Infection. N Engl J Med 2017; 376: 305-17. doi:10.1056/NEJMoa1602615 DOI